www.drugs.com, www.jnj.com, www.healio.com,www.ajmc.com, www.multivu.com: เมื่อวันที่ 30 เมษายน 2568 Johnson & Johnson แจ้งว่า Imaavy (nipocalimab) ซึ่งเป็น human FcRn-blocking monoclonal antibody ได้รับการรับรองจากสำนักงานอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration หรือ FDA) สำหรับใช้ในการรักษาคนไข้ generalized myasthenia gravis (gMG) อายุตั้งแต่ 12 ปีขึ้นไป ที่มี anti-acetylcholine receptor (AChR)หรือ anti-muscle-specific kinase (MuSK) antibodies เป็นบวก
Imaavy (nipocalimab) ถือเป็น FcRn blocker ตัวใหม่ และยังเป็น FcRn blocker ตัวแรกและตัวเดียวเท่านั้น ในปัจจุบันที่ได้รับการรับรองจาก FDA สำหรับใช้รักษา gMG ในกลุ่มประชากรคนไข้เด็กและผู้ใหญ่ที่มี AChR และ MuSK antibodies เป็นบวก โดยบริหารยาด้วยการฉีดเข้าทางหลอดเลือดดำ (intravenous หรือ IV injection) เสริมเข้ากับการรักษามาตรฐาน (standard of care หรือ SOC) เช่น acetylcholinesterase inhibitor, immunosuppressants หรือ steroids
ข้อมูลหลักที่ FDA ใช้ประกอบการพิจารณาให้การรับรอง nipocalimab ในข้อบ่งใช้ดังกล่าว ก็คือผลของการศึกษาทางคลินิกที่เป็น registration trial ที่มีชื่อว่า Vivacity-MG3 ซึ่งเป็นการศึกษาแบบ phase 3, randomized, double-blind, placebo-controlled study ในคนไข้ gMG อายุตั้งแต่ 18 ปีขึ้นไป จำนวนทั้งสิ้น 153 คนที่ส่วนใหญ่ (85%) มีผลตรวจ AChR เป็นบวก และอีกราวๆ 8% มีผลตรวจ MuSK เป็นบวก โดยคนไข้เหล่านี้ที่ได้รับการรักษาด้วย SOC อยู่ก่อนแล้ว แต่ยังควบคุมอาการได้ไม่ดีพอ ถูกสุ่ม (1:1) ออกเป็น 2 กลุ่ม กลุ่มหนึ่งจำนวน 77 คน ได้รับ (30 mg/kg IV loading dose followed by 15 mg/kg every two weeks) ร่วมกับ SOC เป็นเวลา 24 สัปดาห์ ขณะที่อีกกลุ่มหนึ่งจำนวน 76 คน ได้รับ matching placebo ร่วมกับ SOC เป็นเวลา 24 สัปดาห์เช่นกัน
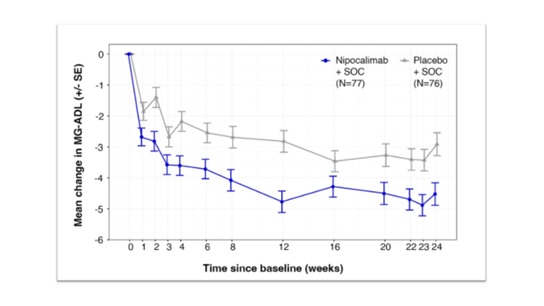
ประเมินเป้าประสงค์หลักในเรื่องประสิทธิภาพของการรักษา (primary efficacy endpoint) ด้วย Myasthenia Gravis Activities of Daily Living หรือ MG-ADLscore ที่ประเมินโดยคนไข้เอง ซึ่งบ่งบอกถึงความรุนแรงของอาการที่มีผลกระทบต่อความสามารถในการทำกิจกรรมต่างๆ ในชีวิตประจำวันของคนไข้ (การเปลี่ยนแปลงโดยเฉลี่ยของ MG-ADL total score จากเมื่อเริ่มต้นการศึกษาไปจนถึงที่ 22, 23 และที่ 24 สัปดาห์ของการศึกษา โดย 0 คะแนนเท่ากับปกติและไล่เรียงระดับความรุนแรงไปจนถึง 24 คะแนนเท่ากับรุนแรงมาก) ขณะเดียวกันก็ประเมินความอ่อนแอของกล้ามเนื้อที่เกี่ยวข้องกับ gMG ด้วย QMG score (Quantitative Myasthenia Gravis; คะแนนตั้งแต่ 0 ไปจนถึง 39 โดยคะแนนยิ่งมากแสดงว่ากล้ามเนื้อยิ่งอ่อนแอ) ซึ่งประเมินโดยแพทย์ เพื่อดูการเปลี่ยนแปลงของ QMG score จากเมื่อเริ่มต้นการศึกษาไปจนถึง 22 สัปดาห์ และที่ 24 สัปดาห์ของการศึกษา
ผลการศึกษาของ Vivacity-MG3 ที่ได้รับการตีพิมพ์ในวารสาร Lancet Neurology ฉบับเดือนกุมภาพันธ์ ปี 2025 ในเรื่องของ primary efficacy endpoint พบว่ากลุ่มคนไข้ gMG ที่ได้รับ nipocalimab ร่วมกับ SOC มีการลดลงของ MG-ADL score จากเมื่อเริ่มต้นการศึกษาไปจนถึงที่ 22, 23 และที่ 24 สัปดาห์ ดีกว่าอย่างมีนัยทางสถิติ เมื่อเทียบกับกลุ่มคนไข้ที่ได้รับ placebo ร่วมกับ SOC กล่าวคือ –4.70 เทียบกับ –3.25 ตามลำดับ ซึ่งการลดลงอย่างมีนัยสำคัญของ MG-ADL score ย่อมส่งผลให้คนไข้กลับมามีความสามารถในการทำกิจกรรมต่างๆ ในชีวิตประจำวันได้ดีขึ้น ไม่ว่าจะเป็น การเคี้ยว การกลืน การพูด และรวมถึงการหายใจ
ขณะที่ผลการศึกษาที่เป็นเป้าประสงค์รอง(secondary endpoint) ในเรื่องความอ่อนแอของกล้ามเนื้อที่เกี่ยวข้องกับ gMG จากการประเมินด้วย QMG score โดยแพทย์ พบว่ากลุ่มคนไข้ที่ได้รับ nipocalimab ร่วมกับ SOC มี QMG score ลดลงได้ดีกว่าอย่างมีนัยสำคัญทางสถิติ เมื่อเทียบกับกลุ่มคนไข้ที่ได้รับ placebo ร่วมกับ SOC กล่าวคือ –4.86 เทียบกับ –2.05 ตามลำดับ พร้อมกันนี้ยังพบว่า nipocalimab สามารถลด median (IQR) immunoglobulin G levels ลงได้ภายในเวลาอันรวดเร็ว กล่าวคือลดลงได้ถึง 74.6% ภายใน 2 สัปดาห์ และ 68.8% ที่ 24 สัปดาห์ของการศึกษา
สำหรับข้อมูลด้านความปลอดภัยโดยรวม พบว่าอุบัติการณ์ไม่พึงประสงค์ส่วนใหญ่ที่มีรายงานพบได้ใน Vivacity-MG3 มีความรุนแรงเล็กน้อยถึงปานกลางเท่านั้น โดยไม่มีความแตกต่างกันอย่างมีนัยสำคัญระหว่าง 2 กลุ่มในเรื่องของ infusion-related reactions, infections และ severe infections หรือ infections ที่จำเป็นต้องแก้ไขด้วย IV anti-infective, operative หรือ invasive intervention
นอกจากนี้ ยังมีข้อมูลของ nipocalimabจาก open-label Phase 2/3 study ที่มีชื่อว่า Vibrance-MG study ซึ่งมุ่งประเมินประสิทธิภาพและความปลอดภัยของ nipocalimab ในคนไข้ gMG ที่เป็นเด็ก โดยการศึกษานี้ยังไม่แล้วเสร็จและในเบื้องต้นได้มีการคัดเลือกเด็กอายุ 12-17 ปีจำนวน 7 คนที่ได้รับการวินิจฉัย gMG ตามเกณฑ์ของ Myasthenia Gravis Foundation of America (MGFA) และมี AChR หรือ MuSK antibodies เป็นบวก เข้าไว้ในการศึกษา ซึ่งในช่วง open-label Active Treatment Phase เป็นเวลา 24 สัปดาห์ คนไข้เด็ก gMG เหล่านี้ได้รับ nipocalimab (30 mg/kg IV loading dose followed by 15 mg/lg IV) ทุกๆ 2 สัปดาห์
ผลการศึกษาที่ได้รับการนำเสนอในงานประชุมประจำปี 2024 ของ American Association of Neuromuscular & Electrodiagnostic Medicine (AANEM) ซึ่งจัดขึ้นระหว่างวันที่ 15-18 ตุลาคม 2024 ในเมือง Savannah มลรัฐ Georgia ของสหรัฐอเมริกา พบว่า nipocalimab บรรลุเป้าประสงค์หลักของการศึกษาด้วยการลด total serum immunoglobulin (IgG) ลงได้อย่างมีนัยสำคัญทางสถิติ โดยมี mean percent change ของ total serum IgG จากเมื่อเริ่มต้นการศึกษาไปจนถึงสัปดาห์ที่ 24 อยู่ที่ –68.98 % ขณะเดียวกันพบว่า MG-ADL score และ QMG score ที่บ่งบอกถึงความรุนแรงของโรคก็ลดลงอย่างมีนัยสำคัญด้วย กล่าวคือ –2.40 และ –3.80 ตามลำดับ
"Imaavy (nipocalimab) ถือเป็น FcRn blocker ตัวใหม่และยังเป็น FcRn blocker ตัวแรกและตัวเดียวเท่านั้นในปัจจุบันที่ได้รับการรับรองจาก FDA สำหรับใช้รักษา gMG ในกลุ่มประชากรคนไข้เด็กและผู้ใหญ่ที่มี AChR และ MuSK antibodies เป็นบวก"